Seguir a @publialcek Twittear
Convertir vídeos
Habréis ido a los lugares más recónditos de internet y habréis encontrado miles de programas para convertirlos. Yo también he hecho eso, y los dos programas que mejor me han funcionado son estos:
SUPER (tarda mucho en convertir los vídeos, depende del procesador que tengáis)
AVS Vídeo converter
Espero que os sirvan
Imprimir documentos como si fuera un libro-PDF Booklet Creator
SLOVOED
Os traigo uno de los mejores traductores (para mi) offline que conozco.
Es el SlovoEd. Lo llevo usando desde mi andadura con las Palms, y nunca me ha fallado.
Os dejo el link de descarga: http://www.fileserve.com/file/YxRWDjs
Una vez que lo ejecutéis en vuestro SGS, se descargará unos 80Mb de diccionarios, directa a la memoria del terminal, y una vez descargados, deberéis activar el programa con la siguiente clave: A1017D-62355-95139-89432.
Para registrarlo abrimos el programa, pulsamos menú y luego la opción registrar, y ya metes ese código, de esta forma tendrás el traductor 100% funcional.
Espero que lo disfrutéis!
Un saludo,
Mensaje extraido de http://www.samsunggalaxys.es/viewtopic.php?f=33&t=1499
Conocer la operadora de un número móvil
http://www.numberingplans.com/?page=analysis&sub=phonenr Este primero nos ofrece la información de la operadora en la que se dio de alta ese número de teléfono, que seguirá siendo la misma siempre que no se haya realizado ninguna portabilidad.
Pero esta otra página es mucho más útil: http://www.cmt.es/estado-portabilidad-movil#SelectOption.do
Nos permite conocer la operadora a la que actualmente pertenece ese número de móvil.
Partes del discurso clásico
Las partes del discurso clásico son cuatro: EXORDIO, EXPOSICIÓN,ARGUMENTACIÓN, PERORACIÓN
1. Exordio
Busca atraer al auditorio buscando su complicidad, granjeando simpatías, ganándose la confianza y el interés. Se pretende que el oyente se identifique con quien está en el uso de la palabra...
2. Exposición o Narración
Es la parte más amplia del discurso. En él se narran los hechos necesarios que posteriormente utilizará para demostrar la conclusión que intenta promulgar...
3. Argumentación
Se exponen las pruebas que confirman la conclusión que se pretende inculcar. Se basa en el uso de argumentos lógicos...
4. Peroración
En esta parte se induce al al público a inclinar su voluntad a favor de los fines que pretende conseguir...
Reactivo limitante Química
Reactivo Limitante
Cuando se ha ajustado una ecuación, los coeficientes representan el número de átomos de cada elemento en los reactivos y en los productos. También representan el número de moléculas y de moles de reactivos y productos.
Cuando una ecuación está ajustada, la estequiometría se emplea para saber las moles de un producto obtenidas a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación ajustada. A veces se cree equivocadamente que en las reacciones se utilizan siempre las cantidades exactas de reactivos. Sin embargo, en la práctica lo normal suele ser que se use un exceso de uno o más reactivos, para conseguir que reaccione la mayor cantidad posible del reactivo menos abundante.
Reactivo limitante
Cuando una reacción se detiene porque se acaba uno de los reactivos, a ese reactivo se le llama reactivo limitante.
Aquel reactivo que se ha consumido por completo en una reacción química se le conoce con el nombre de reactivo limitante pues determina o limita la cantidad de producto formado.
Reactivo limitante es aquel que se encuentra en defecto basado en la ecuación química ajustada.
Ejemplo 1:
Para la reacción:

¿Cuál es el reactivo limitante si tenemos 10 moléculas de hidrógeno y 10 moléculas de oxígeno?
Necesitamos 2 moléculas de H2 por cada molécula de O2
Pero tenemos sólo 10 moléculas de H2 y 10 moléculas de O2.
La proporción requerida es de 2 : 1
Pero la proporción que tenemos es de 1 : 1
Es claro que el reactivo en exceso es el O2 y el reactivo limitante es el H2
Como trabajar con moléculas es lo mismo que trabajar con moles.
Si ahora ponemos 15 moles de H2 con 5 moles de O2 entonces como la estequiometría de la reacción es tal que 1 mol de O2 reaccionan con 2 moles de H2, entonces el número de moles de O2 necesarias para reaccionar con todo el H2 es 7,5, y el número de moles de H2 necesarias para reaccionar con todo el O2 es 10.
Es decir, que después que todo el oxígeno se ha consumido, sobrarán 5 moles de hidrógeno. El O2 es el reactivo limitante
Una manera de resolver el problema de cuál es el reactivo es el limitante es:
Calcular la cantidad de producto que se formará para cada una de las cantidades que hay de reactivos en la reacción.
El reactivo limitante será aquel que produce la menor cantidad de producto.
Ejemplo 2:
Se necesita un cierre, tres arandelas y dos tuercas para construir una baratija. Si el inventario habitual es 4,000 cierres, 12,000 arandelas y 7,000 tuercas. ¿Cuantas baratijas se pueden producir?
La ecuación correspondiente será:

En esta reacción, 1 mol de cierres, 3 moles de arandela y 2 moles de tuercas reaccionan para dar 1 mol de baratijas.
1) Divide la cantidad de cada reactivo por el número de moles de ese reactivo que se usan en la ecuación ajustada. Así se determina la máxima cantidad de baratijas que pueden producirse por cada reactivo.
- Cierres: 4,000 / 1 = 4,000
- Arandelas: 12,000 / 3 = 4,000
- Tuercas: 7,000 / 2 = 3,500
Por tanto, el reactivo limitante es la tuerca.
2) Determina el número de baratijas que pueden hacerse a partir del reactivo limitante. Ya que el reactivo limitante es la tuerca, el máximo número de baratijas que pueden hacerse viene determinado por el número de tuercas. Entran dos tuercas en cada baratija, de modo que el número de bsratijas que pueden producirse, de acuerdo con la estequiometría del proceso es:
http://www.eis.uva.es/~qgintro/esteq/tutorial-04.html
Energia de Red- Ciclo Born-Haber
Ciclo de Born-Haber
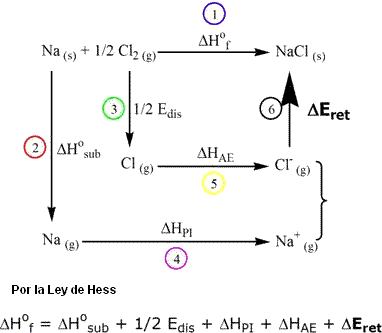
En 1917, Born y Haber propusieron un ciclo termodinámico para el cálculo de la energía del retículo de sustancias iónicas ((ΔEret). El cálculo se realiza según la Ley de Hess. En este ciclo, es tomada en consideración la reacción heterogénea para la síntesis de la sal.
A) Para compuestos del tipo MX (por ejemplo: NaCl, KBr, CsI etc.):
b) Para compuestos del tipo MX2 (por ejemplo CaF2, MgBr2 etc.):

Con excepción del ΔEret, todos los otros valores son tabulados o pueden ser obtenidos experimentalmente. Las entalpías mostradas indican:
- ΔHof = entalpía padrón de formación del sólido iónico. La entalpía padrón de formación de una sustancia es el calor (a presión constante) liberado o consumido en la formación de 1 mol de la sustancia a partir de sustancias simples en estado padrón (estado físico y alotrópico más estable a 298 K y 1 atm). Por convención las sustancias elementales tienen entalpía padrón igual a cero.
- ΔHosub = entalpía de sublimación (o vaporización) del metal.
- Edis = energía de disociación – energía necesaria para disociar (X2 → 2X) 1 mol de moléculas de gas. También llamada energía de atomización.
- ΔHPI = potencial de ionización.
- ΔHAE = variación de entalpía asociada al proceso de afinidad electrónica (A.E.) (energía de electroafinidad)
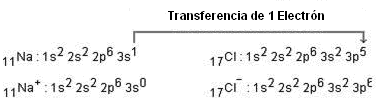
Para que exista formación de cloruro de sodio, debe ocurrir transferencia de electrones (reacción redox). El ciclo de Born-Haber intenta mostrar la energía de las etapas involucradas en la reacción entre las sustancias en sus formas elementales. En el caso específico del cloruro de sodio, la transferencia de electrones se da del solido para el cloro.
Las etapas indicadas en el ciclo de Born-Haber para el NaCl son las siguientes:
- Reacción heterogénea de formación de la sal a partir de las sustancias simples. Na (s) + ½ Cl2 (g) → NaCl (s) (ΔHof = -411,1 kJ/mol).
- Vaporización (sublimación) del sólido metálico, que es sólido a temperatura ambiente. Na (s) → Na (g) (ΔHosub = +107,8 kJ/mol).
- Disociación (quiebre homogéneo) de la molécula biatómica de Cl2, generando átomos de cloro. Cl-Cl (g) → 2 Cl (g) (Edis = +121 kJ/mol). Entonces, 1/2 Edis = 119,9 kj/mol.
- Ionización del sodio en fase gaseosa. Na (g) → Na+ (g) + 1e (ΔHPI = +495,4 kJ/mol).
- Formación de Cl- en fase gaseosa. Afinidad electrónica y la energía liberada por la adición de un electrón a un átomo en estado gaseoso. Cl (g) + 1e → Cl- (g) (ΔHAE = -348,8 kJ/mol).
- Formación de los pares iónicos en fase gaseosa [Na+Cl-], en virtud de la atracción electroestática. El balanceo entre la atracción y la repulsión electroestática provoca el establecimiento de una distancia interiónica de equilibrio volviendo el sistema más estable que los iones aislados. Estos pares están en forma gaseosa, pero, bajo la atracción electroestática que es ejercida sobre todos los iones, el conjunto de pares va aumentando. De esa forma comienza a ocurrir la reunión y superposición de los pares, hasta que sea formado un único grupo que constituirá un sólido cristalino macroscópico tridimensional, de geometría definida y estable. La estabilidad es alcanzada debido al abatimiento de energía del sistema ligado, provocado por la liberación de energía: la energía reticular (ΔEret). Así ΔEret puede ser considerada una medida de la energía (o fuerza) de enlace iónico. Luego, cuanto menor el valor de ΔEret, mayor es la energía liberada en esta etapa, más estable es el retículo cristalino. En el caso del NaCl, usando la Ley de Hess, tenemos ΔEret = -785,4 kj/mol. La formación de otros compuesto iónicos ocurre de manera análoga a aquella propuesta para el NaCl, respetando es claro, las peculiaridades de cada ciclo y la estequiometría de las sales.
La energía potencial total es la suma de todas las energías involucradas en las etapas. Por tanto, la energía reticular expresa la fuerza con que están unidas las partículas de un sólido cristalino y depende de la intensidad de la fuerza de interacción entre los iones y la geometría del retículo. Cuanto menor la distancia interiónica catión-anión, mayor la atracción entre las cargas opuestas.
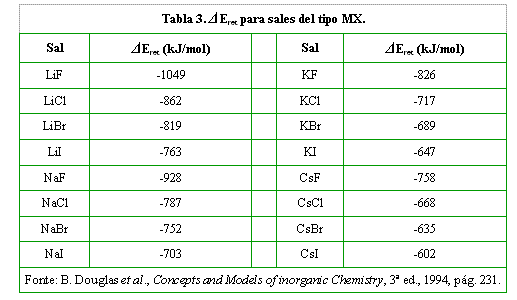
Veamos la siguiente tabla, con algunos valores para ΔEret.
En suma:
- La formación de iones gaseosos a partir de sustancias simples implica un aumento resultante en la energía potencial:
- La condensación de los iones para formar un sólido iónico lleva a una disminución en la energía potencial correspondiente a la energía del retículo:
- Cuanto menor la distancia interiónica catión-anión, mayor la atracción:
- Consecuentemente, menor (o mayor en módulo) es el valor de ΔEret. Así, mayor es la estabilidad del retículo cristalino.
La posibilidad de formación del compuesto iónico a partir de sus elementos ocurre cuando la disminución de energía potencial fuese mayor que el aumento. En otras palabras, la sal solo cristalizará si existe liberación de energía en su formación. Siendo así, la energía de red exotérmica precisa ser mayor que la combinación endotérmica de los factores involucrados en la formación de los iones en fase gaseosa. En caso contrario, el compuesto iónico no se forma, o forma una red cristalina inestable
